本台再跟進香港公立醫院轉用部分大陸製西藥。當局回應未曾否認有關藥物「未在香港註冊」,聲稱「透過特區政府從內地政府認可渠道」採購涉事的大陸製藥物,但未指明引進渠道是中國大陸哪個相關部門。加上早前有港媒揭發醫管局透過「Named Patient」(指定病人)計劃引入多款大陸藥物,令人擔心當局繞過現行法律程序來進口未經註冊的藥物。
港府拒作清楚公開交代 令社會難以監察
本台早前曾 報道,本月初,香港多間公立醫院處方至少3款分別來自中國大陸藥廠「中美史克」、「地奧集團」、「成都通德」生產的撲熱息痛(Paracetamol),其包裝印有「对乙酰氨基酚片」中文簡體字樣,以及國藥集團致君(深圳)製藥有限公司生產的「注射用頭孢西丁鈉」抗生素。有關藥物未見有印有「HK-XXXXX」樣式的香港註冊號碼,截至7月21日,衛生署網頁仍未見有關藥物註冊資料。情況引起社會關注。
當局並無否認涉事藥物「未在香港註冊」
醫管局就事件最新於過去的周日(17日)發 聲明澄清,指有個別媒體「涉嫌指控或暗示本局進口和使用未經許可藥物,醫管局對此失實言論,深表遺憾」。惟當局對過去引入國產藥數量、來源和所謂的負責具體部門等拒作清楚公開交代,而且港府醫務衛生局、醫管局和衛生署回覆傳媒查詢時,均並無否認涉事藥物「未在香港註冊」。
另外,醫管局解釋,「在特殊情況或當藥物出現未能預計的供應問題時,如因疫情嚴峻導致個別藥物供應緊張,醫管局或需要從不同地區進口採購合約以外的藥物」。當局不論其生產地,均按照香港相關法例進口和當局的既定程序審批。
但到底醫管局引入多少大陸藥物來填補有關的供應空缺?當局就以「沒有備存」及「涉及與藥物供應商的商業協議及商業敏感資料」為由,拒詳細交待。
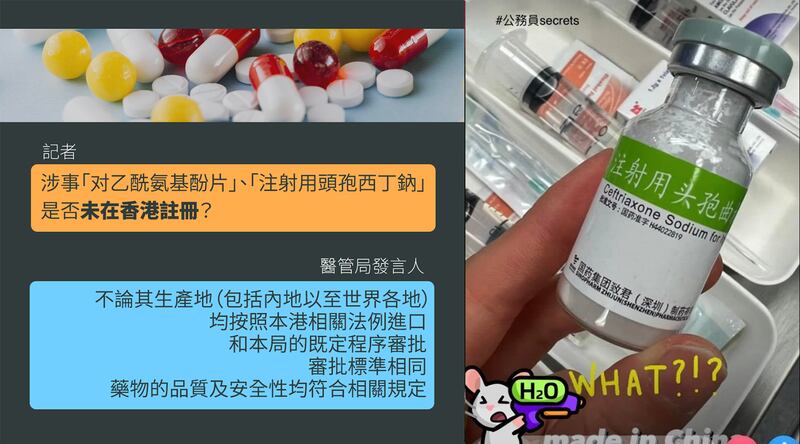
醫管局強調「透過特區政府從內地政府認可渠道」採購
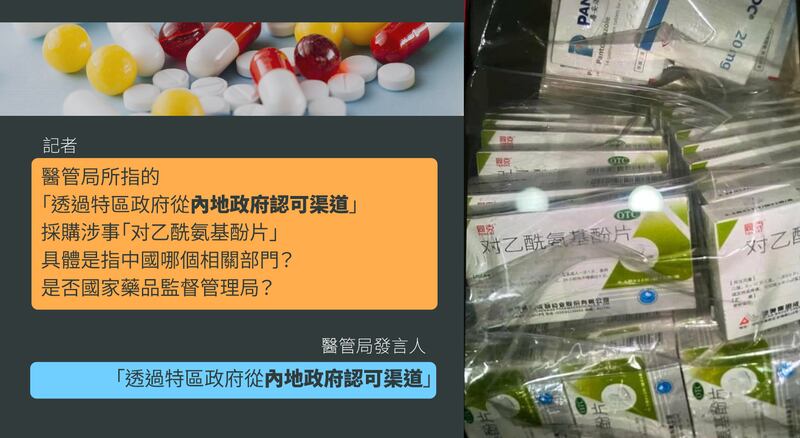
至於批准引入未經註冊藥物的部門是誰?醫管局分別於7月7日、7月11日回覆本台時稱引入安排「獲得政府有關部門許可」。周日聲明中則指,當局「透過特區政府從內地政府認可渠道」採購涉事的「对乙酰氨基酚片」。惟當中具體是指中國哪個相關部門?是否指國家藥品監督管理局?當局無具體交代。。
據香港現行《藥劑業及毒藥條例》(第138章),所有在香港銷售及供應的「藥劑製品」,必須先獲香港藥劑業及毒藥管理局批准註冊。有關條例僅容許註冊醫生「為治療特定病人或進行臨牀試驗,而進口未經註冊的藥劑製品供管有及使用」。
港府亦多次強調,中港藥物註冊制度有別,大陸藥進港須先在香港註冊,而「公立醫院如有需要從海外引進未有在香港註冊的藥物供病人使用,會按衛生署規定申請及經其審批」。
值得留意是,而次事件中醫管局的說法,並無交代是否曾按香港現行法例和程序,經衛生署獲發進口證後,才引入「对乙酰氨基酚片」,抑或是「透過特區政府從內地政府認可渠道」進口就可獲有關豁免?
然而,當局就引入大陸製抗生素「注射用頭孢西丁鈉」時特別稱,當局根據法例定「通過註冊醫生為治療特定病人進口」,即以「Named Patient」方式,並根據《進出口條例》(第60章)向衛生署申請進口證,以進口有關藥物。但未有以同樣說法去解釋「对乙酰氨基酚片」的引入程序。
為「特定病人」進口未經註冊藥物 有嚴格指引和規定
而據衛生署藥物辦公室網頁資料,就註冊醫生為治療「特定病人」而進口未經註冊的藥劑製品供管有及使用,有嚴格 指引和規定。當中包括須向衛生署提交「特定病人」名單、由製造商或進行測試公司發出該藥物的化驗分析證明書;以及在開藥前向病人告知有關風險,並獲對方同意。
不過,醫管局一直稱「未有數據曾向哪些病人處方內地生產藥物」,亦無交代處方有關未經香港註冊藥物前,是否已獲病人同意。當局只稱「藥劑部職員會因應實際情況提供所需訊息給前線員工及病人,確保用藥正確」。
香港醫院藥劑師學會會長崔俊明周二(19日)在港台節目《千禧年代》稱,公院處方未經註冊藥物的情況常見,而今次涉事的抗生素屬「用於一線治療的常用藥」,形容主要為「救命」,引入的過程由衛生署負責,確保符合良好製藥規範,即使非原廠藥,效果也一樣。
崔俊明說:為何需要特別向(中國)國內買呢?因為外國已停產,而(中國)國內仍可生產,而這藥是常用的抗生素,是用於一線治療。如果斷了(供應),當然可以找代替品,但一些癌症病人已試用代替品未見效,還是要用這款一線治療的常用抗生素。這形式採藥是普遍,最重要是有衛生署把關。
資深醫生:醫管局利用Named Patient「法律罅」
有要求匿名的曾任職香港公院的資深醫生向本台稱,通常就新藥及罕見病藥物,在特殊緊急情況下,才會以「Named Patient」形式引入未經註冊藥物,形容醫管局近年多了嘗試用這「法律罅」入藥,又指醫管局「透過特區政府從內地政府認可渠道」引入未經註冊藥亦愈趨常見。
該資深醫生說:好明顯這些抗生素、止痛藥是常用藥,如何稱之為「Named Patient」?「Named Patient」通常是特定病人或罕有病人,醫管局是利用這「法律罅」。是否醫管局一心想用大陸藥?我只能如此說,這幾年不但為了展示與大陸的友好,為成本控制、供應問題,不用大陸藥的傾向是愈來愈少,但是否傾向主力用大陸藥?亦未致於。現時醫管局用藥,都是以質量水平合格為原則。
《傳真社》2020年3月初 曾跟進調查公院用未註冊大陸藥
事實上,早於2020年3月初,香港東區醫院被揭發使用未經香港註冊、內地製的抗生素,當時《傳真社》曾跟進 調查發現,醫管局透過原本為特定病人引入新藥或罕見病藥物的「Named Patient」(指定病人) 計劃,將未經註冊的常用藥物引入公共醫院,並據2020年首4個月收集到的內部文件,發現東區醫院、伊利沙伯醫院、明愛醫院、屯門醫院、廣華醫院及瑪嘉烈醫院,至少有82款藥物未經註冊。
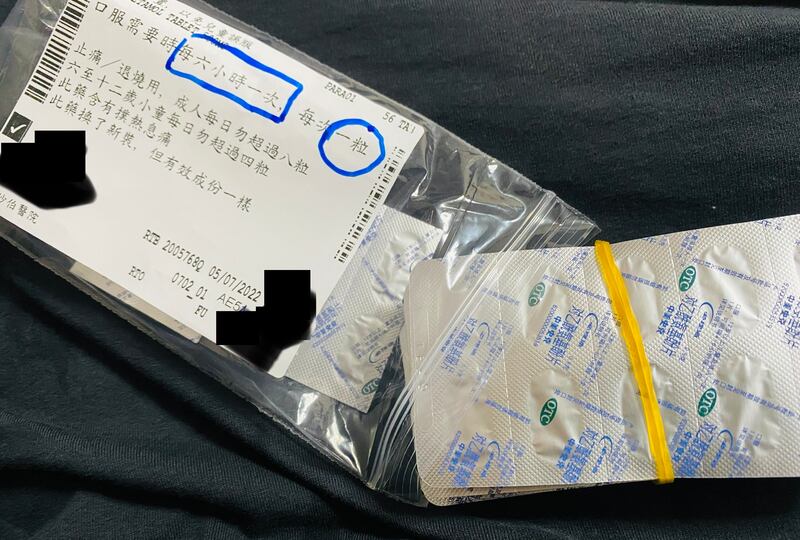
報道又指,公院換未經註冊的替代藥情況頻繁。例如2020年3月初,東區醫院被揭發使用由山東瑞陽製藥生產的抗生素「注射用哌拉西林钠他唑巴坦钠」,但同月27日已換回香港註冊、由印度Aurobindo Pharma生產的同款藥物。其後東區醫院於4月底再次採用山東瑞陽製藥的抗生素,5月初又換回美國輝瑞藥廠生產已獲註冊版本。
但報道指,醫生處方時未必知情,藥房派藥亦不會主動告知病人,病人亦未必留意到。本台據悉,對於藥物更改,院方多數只在藥袋或包裝上貼上標籤稱「此藥已換上新裝,但成份一樣」。
另外,時任食物及衛生局副局長徐德義曾於今年3月在立法會,就大陸版「連花清瘟膠囊」未在港註冊回應稱,「所有中央提供的支援,包括該藥物批次,都已獲豁免註冊」。
港府曾於2002年詳細交待購買大陸製藥情況
本台追溯到2002年6月的立法會 文件,當時時任衛生福利局局長楊永強書面回覆時任立法會議員吳亮星時,指在1999年至2002年,購買大陸製造藥物的開支平均每年為約1.2億港元,佔當時醫管局總藥物開支的約7%。
衛生署現行的PLAMMS系統一直監察和追蹤進出口未經註冊的藥劑製品。近日本台向衛生署查詢過去2年未經註冊藥物進口許可證數字及進口清單,以及當中大陸供港佔比分別每年是多少?署方僅回覆稱,2020年1月1日至2022年6月30日,共批出16,814張相關進口許可證。衞生署沒有整存有關進口清單以及不同地區進口比例的資料。
而本台就有關問題詳細列明並向醫管局查詢具體的答案,當局均無正面回應,僅以局方於周日的聲明內容回覆。
記者:李若如 責編:李世民 網編:劉定堅
